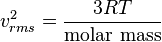Sebuah lemari es (sering disebut kulkas "" singkatnya) adalah sebuah pendingin alat yang terdiri dari termal terisolasi kompartemen dan pompa panas -kimia atau mekanis berarti-untuk mentransfer panas dari ke lingkungan eksternal, pendinginan isi ke suhu di bawah ambien. Cooling is a popular food storage technique in developed countries and works by decreasing the reproduction rate of bacteria. Pendinginan adalah populer teknik penyimpanan makanan di negara maju dan bekerja dengan mengurangi tingkat reproduksi bakteri. The device is thus used to reduce the rate of spoilage of foodstuffs. Perangkat demikian digunakan untuk mengurangi tingkat pembusukan bahan pangan. A device described as a "refrigerator" maintains a temperature a few degrees above the freezing point of water; a similar device which maintains a temperature below the freezing point of water is called a " freezer ." Sebuah perangkat digambarkan sebagai kulkas "" mempertahankan suhu beberapa derajat di atas titik beku air, sebuah perangkat yang mirip yang mempertahankan suhu di bawah titik beku air disebut kulkas "." The refrigerator is a relatively modern invention among kitchen appliances . lemari es adalah penemuan modern yang relatif antara peralatan dapur . It replaced the icebox , which had been a common household appliance for almost a century and a half prior. Ia menggantikan lemari es , yang telah menjadi alat rumah tangga biasa selama hampir satu setengah abad sebelum. For this reason, a refrigerator is sometimes referred to as an " icebox ." Untuk alasan ini, lemari es kadang-kadang disebut sebagai lemari es

1. Istilah-istilah Refrigerasi
Obyek: Suatu benda, zat, atau ruangan, yang padanya dikenakan proses refrigerasi, atau yang menerima dampak dari proses refrigerasi.
Lingkungan: Suatu tempat di mana sebuah obyek berada. Dalam konteks refrigerasi biasanya, meskipun tidak selalu, lingkungan menyatakan ruang udara alami di sekitar obyek.
Lingkungan alami: Lingkungan yang asli, dengan kondisi yang kita dapati sebagaimana apa adanya.
Lingkungan buatan: Lingkungan yang secara sengaja dibuat berbeda dari kondisi asli alaminya dengan sesuatu cara, salah satunya adalah dengan mengenakan proses refrigerasi padanya.
Kondisi lingkungan: Sebuah lingkungan dicirikan oleh besaran-besaran fisik yang menjadi indikator kondisinya. Besaran fisik yang mencirikan kondisi lingkungan, antara lain adalah: tingkat suhu, tingkat tekanan, dan tingkat kelembaban dari udara lingkungan.
Refrigerasi: Refrigerasi adalah proses pengambilan kalor dari suatu obyek, yang menyebabkan suhu obyek tersebut menjadi lebih rendah dari suhu lingkungan di mana obyek tersebut berada. Refrigerasi juga mencakup pula proses untuk mempertahankan tingkat suhu obyek yang didinginkan itu agar tetap lebih rendah dari lingkungannya.
Sistem: Gabungan dari seperangkat komponen yang masing-masing mempunyai fungsi yang berbeda-beda, akan tetapi secara keseluruhan bersama-sama menghasilkan sebuah fungsi, kegunaan, manfaat atau dampak tertentu.
Sistem refrigerasi: Sistem yang digunakan sebagai sarana untuk memindahkan kalor, yaitu dengan cara menarik kalor dari obyek yang didinginkan, menyalurkan kalor itu, dan kemudian melepaskan/membuangnya ke lingkungan alami, yang suhunya lebih tinggi dari obyek atau benda dari mana kalor tersebut berasal.
Refrigeran: Suatu senyawa kimia berbentuk zat alir, yang memiliki sifat-sifat termal antara lain: mudah berubah bentuk atau fasa akibat perubahan besaran-besaran fisiknya (suhu dan tekanan). Proses perubahan fasa tersebut melibatkan penyerapan ataupun pelepasan kalor dalam jumlah yang cukup besar. Refrigeran berfungsi sebagai media penukar kalor pada sistem refrigerasi.
Beban refrigerasi: Banyaknya energi termal dari sebuah obyek yang harus diserap atau ditarik oleh sebuah sistem refrigerasi. Energi termal tersebut membebani sistem, atau menjadi beban yang harus ditanggung oleh sistem.
Kapasitas refrigerasi: Ukuran dari kemampuan sistem refrigerasi untuk menanggung beban refrigerasi dari sebuah obyek. Biasanya sebuah unit refrigerasi (sistem) dipilih yang mempunyai kapasitas lebih besar, atau sekurangnya sama, dengan besarnya beban refrigerasi yang akan ditanggungnya.
2. Sistem Refrigrasi Mekanik
Pada sistem refrigrasi mekanik kompresi uap terdapat rangkaian dari empat komponen utama, yaitu: evaporator, kompresor, kondenser, dan alat pengontrol aliran refrigeran. Masing-masing komponen mempunyai ciri dan fungsi sendiri-sendiri yang berbeda, tetapi secara terintegrasi dan dioperasikan bersama-sama akan dapat memindahkan energi termal. Dampak dari pengoperasian sebuah sistem refrigerasi pada sebuah obyek adalah, bila terambil sebagian energi yang terkandung di dalamnya, suhu obyek tersebut akan menurun. Sebaliknya, karena operasi sistem refrigerasi itu kemudian sejumlah energi termal terpindahkan ke lingkungan, maka lingkungan tersebut dapat menjadi lebih hangat. Gambar 1 memperlihatkan fungsi sistem refrigerasi terhadap obyek dan lingkungannya.

Gambar 1. Fungsi sistem refrigerasi terhadap obyek dan lingkungannya, Toby< Tling
Sistem refrigerasi yang digunakan dalam praktikum ini disebut sebagai “sistem mekanik”, yaitu untuk membedakan dari sistem-sistem refrigerasi yang lain. Disebut sistem mekanik karena refrigeran mengalir bersirkulasi di dalam sistem akibat dorongan yang dilakukan secara mekanik. Gambar 2 memperlihatkan skema sebuah sistem refrigerasi sederhana beserta semua komponen utama dan sirkulasi aliran refrigerannya. Sirkulasi aliran refrigeran itu berlangsung berulang-ulang membentuk suatu siklus, yaitu yang dinamakan siklus refrigerasi.

Gambar 2. Komponen utama sistem refrigerasi
3. Komponen Utama Sistem Refrigerasi
Berikut ini uraian ringkas tentang komponen-komponen utama sebuah sistem refrigerasi mekanik. Uraian ini disusun menurut urutan jalur siklusnya, perhatikan skema pada Gambar 2 di atas. Sistem refrigerasi seperti pada gambar itu berisi refrigeran yang disirkulasikan ke seluruh bagian sistem. Refrigeran itu berperan dan berfungsi sebagai media penghantar kalor, dari saat kalor diserap sistem di evaporator, hingga saat dilepas dan dibuang ke lingkungan di kondenser.
1. Kondenser (condenser – CD)
Kondenser adalah komponen di mana terjadi proses perubahan fasa refrigeran, dari fasa uap menjadi fasa cair. Dari proses kondensasi (pengembunan) yang terjadi di dalamnya itulah maka komponen ini mendapatkan namanya. Proses kondensasi akan berlangsung apabila refrigeran dapat melepaskan kalor yang dikandungnya. Kalor tersebut dilepaskan dan dibuang ke lingkungan. Agar kalor dapat lepas ke lingkungan, maka suhu kondensasi (Tkd) harus lebih tinggi dari suhu lingkungan (Tling). Karena refrigeran adalah zat yang sangat mudah menguap, maka agar dapat dia dikondensasikan haruslah dibuat bertekanan tinggi. Maka, kondenser adalah bagian di mana refrigeran bertekanan tinggi (Pkd = high pressure – HP).
2. Piranti ekspansi (expansion device – EXD)
Piranti ini berfungsi seperti sebuah gerbang yang mengatur banyaknya refrigeran cair yang boleh mengalir dari kondenser ke evaporator. Oleh sebab itu piranti ini sering juga dinamakan refrigerant flow controller. Dalam berbagai buku teks Termodinamika, proses yang berlangsung dalam piranti ini biasanya disebut throttling process. Besarnya laju aliran refrigeran merupakan salah satu faktor yang menentukan besarnya kapasitas refrigerasi. Untuk sistem refrigerasi yang kecil, maka laju aliran refrigeran yang diperlukan juga kecil saja. Sebaliknya unit atau sistem refrigerasi yang besar akan mempunyai laju aliran refrigeran yang besar pula. Terdapat beberapa jenis piranti ekspansi. Di bawah ini diterakan beberapa di antaranya.
a. Pipa kapiler (capillary tube – CT).
Berupa pipa kecil dari tembaga dengan lubang berdiameter sekitar 1 mm, dengan panjang yang disesuaikan dengan keperluannya hingga beberapa meter. Pada berbagai unit refrigerasi yang menggunakannya pipa ini biasanya diuntai agar terlindung dari kerusakan dan ringkas penempatannya.
Lubang saluran yang sempit dan panjangnya pipa kapiler ini merupakan hambatan bagi aliran refrigeran yang melintasinya; hambatan itulah yang membatasi besarnya aliran itu. Pipa kapiler ini menghasilkan aliran yang konstan.
b. Katup ekspansi tangan (hand/manual expansion valve – HEV).
Adalah pengatur aliran yang berupa katup atau keran biasa, yang dioperasikan untuk mengatur bukaannya secara manual.
c. Katup ekspansi termostatik (thermostatic expansion valve – TEV).
Pada piranti ini terdapat bagian yang dapat bekerja secara termostatik, yaitu mempunyai sensor suhu yang dilekatkan pada bagian keluaran evaporator. Perubahan suhu yang terjadi pada keluaran evaporator itu menjadi indikator besar-kecilnya beban refrigerasi. Variasi suhu itu dimanfaatkan untuk mengatur bukaan TEV, sehingga besarnya laju aliran melintasinya juga menjadi terkontrol.
d. Katup pelampung (float valve – FV).
Piranti ekspansi jenis ini biasanya dirangkaikan dengan evaporator jenis ‘genangan’ (flooded evaporator, wet evaporator). Ketinggian muka (level) cairan dalam tandon (reservoir) cairan evaporator menjadi pendorong pelampung yang menjadi pengatur besarnya bukaan katup.
3. Evaporator (evaporator – EV)
Evaporator adalah komponen di mana cairan refrigeran yang masuk ke dalamnya akan menguap. Proses penguapan (evaporation) itu terjadi karena cairan refrigeran menyerap kalor, yaitu yang merupakan beban refrigerasi sistem. Terdapat dua jenis evaporator yaitu:
a. Evaporator ekspansi langsung (direct/dry expansion type - DX).
Pada evaporator ini terdapat bagian, yaitu di bagian keluarannya, yang dirancang selalu terjaga ‘kering’, artinya di bagian itu refrigeran yang berfasa cair telah habis menguap sebelum terhisap keluar ke saluran masuk kompresor.
b. Evaporator genangan (flooded/wet expansion type).
Pada evaporator jenis ini seluruh permukaan bagian dalam evaporator selalu dibanjiri, atau bersentuhan, dengan refrigeran yang berbentuk cair. Terdapat sebuah tandon (reservoir, low pressure receiver), di mana cairan refrigeran terkumpul, dan dari bagian atas tandon tersebut uap refrigeran yang terbentuk dalam evaporator tersebut dihisap masuk ke kompresor.
4. Kompresor (compressor – CP)
Kompresor adalah komponen yang merupakan jantung dari sistem refrigerasi. Kompresor bekerja menghisap uap refrigeran dari evaporator dan mendorongnya dengan cara kompresi agar mengalir masuk ke kondenser. Karena kompresor mengalirkan refrigeran sementara piranti ekspansi membatasi alirannya, maka di antara kedua komponen itu terbangkitkan perbedaan tekanan, yaitu: di kondenser tekanan refrigeran menjadi tinggi (high pressure – HP), sedangkan di evaporator tekanan refrigeran menjadi rendah (low pressure – LP).
4. Karta Mollier (Karta Tekanan – Entalpi) dan Siklus Refrigerasi Siklus refrigerasi yang terjadi di dalam sebuah sistem refrigerasi dapat diterakan dan digambarkan diagramnya pada sebuah karta tekanan – entalpi. Penggambaran tersebut dibuat berdasarkan tingkat tekanan (HP dan LP) dan suhu pada berbagai bagian sistem yang dapat diperoleh dengan cara mengukurnya. Gambar 3 menunjukkan gambar diagram suatu siklus refrigerasi.

Gambar 3. Diagram proses refrigerasi
dari benda bersuhu tinggi ~ sebab
dan benda yang bersuhu rendah akan secara spontan menyerap energi tersebut. Benda bersuhu rendah dinyatakan mempunyai energi sebesar
.
x 100%
yang dibaca “eta”
dikurangi
? Karena
adalah energi yang diserap mesin pada tandon (reservoir energi) bersuhu tinggi yang akan melepaskan kalor (energi) secara spontan kepada
(reservoir atau tandon energi bersuhu rendah) yang berfungsi menyerap energi tersebut.
dan energi panas yang dibuang ke luar sistem menuju lingkungan dinyatakan sebagai
karena
selalu lebih besar nilainya dari
maka hasil pembagian fungsi tersebut selalu lebih dari angka 1.
dari benda bersuhu tinggi ~ sebab
dan benda yang bersuhu rendah akan secara spontan menyerap energi tersebut. Benda bersuhu rendah dinyatakan mempunyai energi sebesar
.
x 100%
yang dibaca “eta”
dikurangi
? Karena
adalah energi yang diserap mesin pada tandon (reservoir energi) bersuhu tinggi yang akan melepaskan kalor (energi) secara spontan kepada
(reservoir atau tandon energi bersuhu rendah) yang berfungsi menyerap energi tersebut.
dan energi panas yang dibuang ke luar sistem menuju lingkungan dinyatakan sebagai
karena
selalu lebih besar nilainya dari
maka hasil pembagian fungsi tersebut selalu lebih dari angka 1.




 Gas dikatakan melakukan usaha apabila volume gas bertambah besar (atau mengembang) dan V2 > V1. sebaliknya, gas dikatakan menerima usaha (atau usaha dilakukan terhadap gas) apabila volume gas mengecil atau V2 < V1 dan usaha gas bernilai negatif.
Gas dikatakan melakukan usaha apabila volume gas bertambah besar (atau mengembang) dan V2 > V1. sebaliknya, gas dikatakan menerima usaha (atau usaha dilakukan terhadap gas) apabila volume gas mengecil atau V2 < V1 dan usaha gas bernilai negatif.









 dapat dituliskan sebagai
dapat dituliskan sebagai 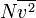 , di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan
, di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan  di mana
di mana 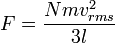

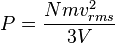

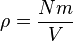 .
.
 yakni suatu sifat
yakni suatu sifat 
 (2)
(2)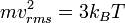

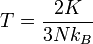 (3)
(3) (4)
(4)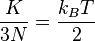 (5)
(5)